シリコン原子
Si(シリコン)は内殻電子を10個(2+2×4)と外殻電子を4個(2+2)をもつ原子構造です.外殻電子は原子の最外殻(もっとも外側)に配置される電子で,図3-1-1(右)に示すように正三角錐の中心に核を配置したときに三角錐の頂点方向に周回電子軌道をもちます.
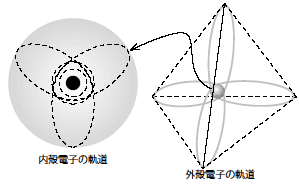
図3-1-1 シリコン14Si原子の構造
この外殻電子は,化学結合(結晶結合も含む)をする際に働く電子です.このような化学結合に関与する電子を価電子といいます.原子の周回電子は軌道に配置される数が明確に定められています.そのような各電子軌道に収容できる数に規律をパウリの排他律といいます.たとえばシリコン原子の最外殻電子軌道は図3-1-1(右)に示す4本の外殻電子軌道に電子をそれぞれ2個ずつ配置させることができ合計8個収容できます.そのため通常のイオン化されていないシリコンは価電子を4個もちますので,イオン化してあと4個を外殻電子軌道に置くことは可能です.
原子は各周回軌道に配置する電子がその電子軌道をブランクなく完全に収容する状態またはその電子軌道の電子が全く無い状態のときに安定する特徴があります.さらに,核のもつプラスの電荷量と周回する電子の総合マイナス電荷量のバランスがとれた状態においても電気的な安定状態となります.
このような条件によって原子と原子が結びつくことを一般に化学結合といいます.そしてその化学結合の強さ(安定性)は,電子軌道の電子配置の条件と電気力(クーロン力)のバランス条件によります.
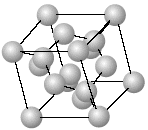
図3-1-2 シリコン結晶の構造
ところでシリコン原子が複数集まって結晶をつくる場合,これまで記した化学的安定の結合条件を踏まえると,結晶を構成するシリコン原子がもつ価電子をお互いに共有することによってお互いの原子の外殻電子軌道を満たし,さらに電気的に中性を保つことができる構造が考えられます.この状態における結合は前に記したように化学的に安定した結合となります.このように価電子を共有して結合する方法を共有結合といいます.
共有結合による結晶の構造はあるシリコン原子を中心に考えたとき,その原子を正三角錐の中心に配置しその正三角錐の各頂点位置に原子を配置されます.そのようにしてつくられるシリコン結晶は図3-1-2 に示すような構造を造ります.この結晶構造をダイヤモンド結合といいます.